eCTD SHAREは、日本(PMDA)の承認申請に向けたeCTD v4.0用のeCTD作成支援システムです。
日本の仕様に特化した使いやすさ、わかりやすさ(見やすさ)を意識して開発しました。
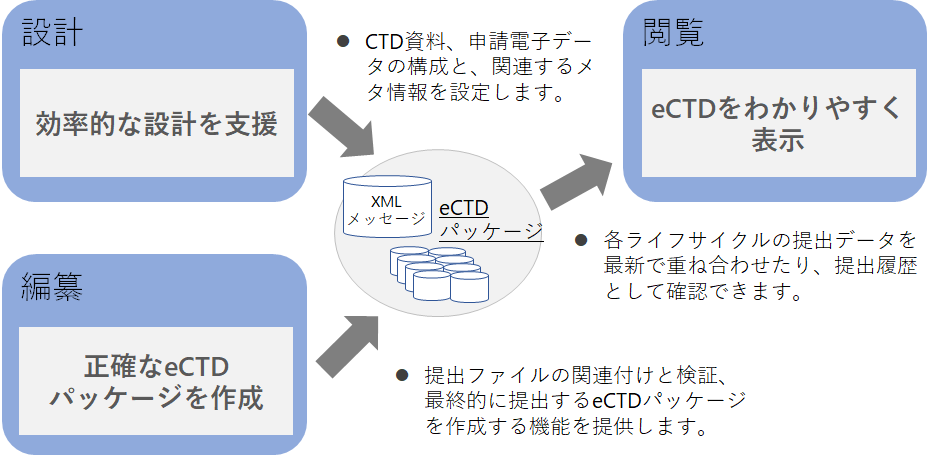
3つの機能
これまでのeCTD v3.2.2におけるeCTD作成支援ツールの多くは「編纂」を主要機能としてきました。これは、v3.2.2では提出するeCTDの設計を主管部門が中心となり、Excel等のツールで管理することができたからではないでしょうか。
eCTD v4.0からは申請電子データをeCTDに含めて提出することになり、属性も種類も増えて且つ辞書化(コード化)して提出する必要があり、部門間のコミュケーションがこれまで以上に重要になると考えています。さらにeCTDの内容を確認手段は当局から提供されなくなり、各社で準備する必要があります。
eCTD SHAREは、これらの課題を解決するために、早い段階から「設計」を開始し、その情報を関係する部門間でいつでも「閲覧」(確認・共有)ができ、その結果をそのまま「編纂」ができるようにしました。
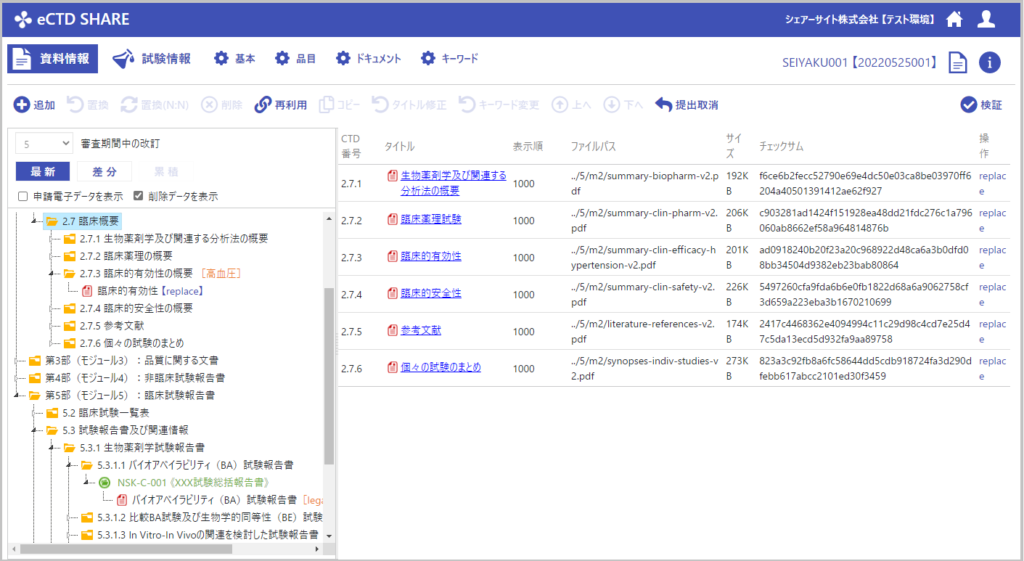
直感的なインターフェース
eCTDの設計(提出資料の構成、メタ情報の設定など)は、eCTD v3.2.2の知識ベースがあれば、直感的に操作できるインタフェースにしています。
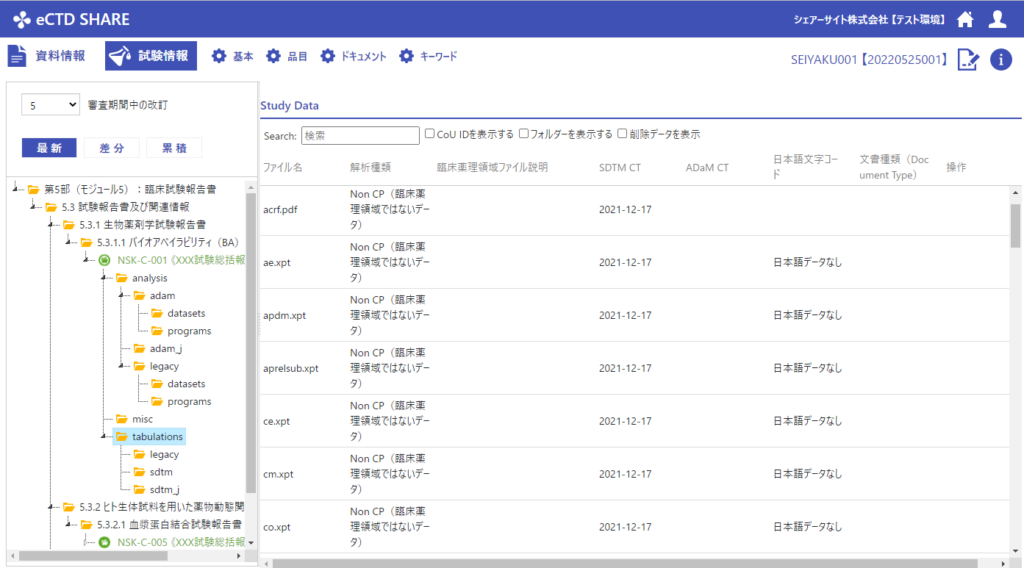
申請電子データの対応
これまではeCTDと別に提出していた申請電子データをeCTDに含めて提出することになります。申請電子データも編纂の対象となりますので、関係部門の連携と情報共有がこれまで以上に重要になってきます。
eCTDに組み込んだ申請電子データのレビューでは、CTDとは別のビューが必要と考え、eCTD SHAREでは、申請電子データを扱うための専用画面を用意しました。
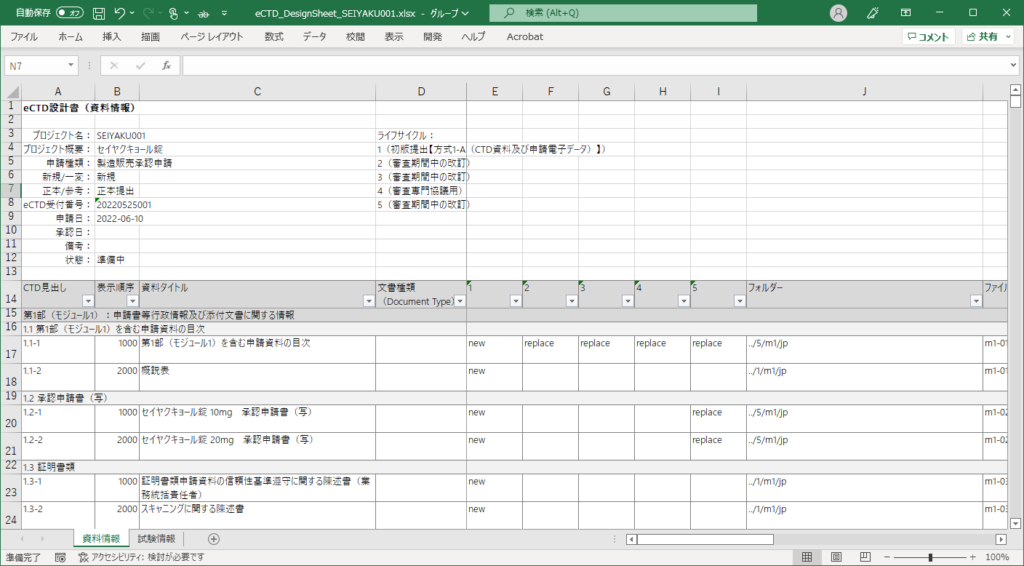
設計情報の確認(レビュー)
eCTD SHAREで設計した内容は、Excelへ出力することができます。オフラインでの確認やレビューで活用していただけます。
eCTDデータの閲覧
eCTD v3.2.2ではICHとPMDA(医薬品医療機器総合機構)が提供するスタイルシートにより、WEBブラウザーがあれば簡単にeCTDの内容を確認することが出来ましたが、v4.0ではスタイルシートの提供はなく、何らかの閲覧手段を用意する必要があります。
eCTD SHAREは3つの機能のうち「閲覧」機能のみの利用も可能です。これにより、eCTD作成の方法(内製/アウトソーシング)によらず、全てのお客様にeCTDを見るための仕組みをご提供します。

